共價鍵的特征共價鍵具有飽和性
更新時間:2021-04-20 點擊次數(shù):5981次
共價鍵是化學鍵中重要的一類���,包括:極性鍵�����、非極性鍵、配位鍵�、單鍵、雙鍵��、叁鍵����、σ鍵、π鍵等類別�����。共價鍵之一原子間通過共用電子對(電子云重疊)所形成的化學鍵叫做共價鍵����。共價鍵之二原子間通過共用電子對(電子云重疊)所形成的化學鍵叫做共價鍵����。共價鍵又稱原子鍵���。
同種原子間形成的共價鍵�����,共用電子對不偏向任何一個原子�,成鍵原子都不顯電性��,這種鍵稱為非極性鍵��。例如H2�����、Cl2����、N2等,在化合物分子中���,不同原子間形成的共價鍵�����,由于不同原子的電負性不同����,共用電子對偏向電負性大的原子,電負性大的原子就帶部分負電荷�,電負性小的原子就帶部分正電荷,這樣的鍵稱為極性鍵�。
同種非金屬原子之間,或不同種非金屬原子之間成鍵時�,一般都是共價鍵。在形成共價鍵時�����,當自旋方向相反的未成對電子的原子相互接近時�,兩個核間電子云密度較大���,即共用電子對屬成鍵的兩原子共有����,圍繞兩個核運動��,受兩核吸引,在兩核間電子云重疊����。
要形成穩(wěn)定的共價鍵,必須盡可能使電子云重疊程度大一些�,我們知道,除了s電子以外�����,其它電子云都是有空間取向的�,在成鍵時,要盡可能沿著電子云密度最大的方向發(fā)生重疊����。例如H2O中,氫原子的1s電子云沿著氧原子的2Px���、2Py電子云的空間伸展方向的重疊�,才能達到電子云重疊程度最大���,形成穩(wěn)定的共價鍵���,因此共價鍵具有方向性��。元素的原子形成共價鍵時�,當一個原子的所有未成對電子和另一些原子中自旋方向相反的未成對電子配對成鍵后���,就不再跟其它原子的未成對電子配對成鍵�����。例如H2O分子中���,O原子有兩個未成對電子,它只能跟兩個H原子的未成對電子配對�,因此,共價鍵具有飽和性�����。
原子在形成共價分子時所形成的共價鍵數(shù)目�,取決于它所具有的未成對電子的數(shù)目��。因此����,一個原子有幾個未成對電子(包括激發(fā)后形成的未成對電子)����,便可與幾個自旋方向相反的未成對電子配對成鍵���。此為共價鍵的飽和性��。兩個氫原子通過自旋方向相反的1s電子配對形成H-H單鍵結合成H2分子后���,就不能再與第三個H原子的未成對電子配對了。氮原子有三個未成對電子��,可與三個氫原子的自旋方向相反的未成對電子配對形成三個共價單鍵��,結合成NH3�。⑵共價鍵的方向性
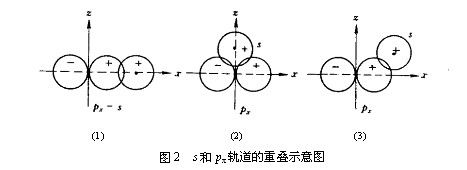
根據(jù)原子軌道最大重疊原理,在形成共價鍵時��,原子間總是盡可能沿著原子軌道最大重疊的方向成鍵����。軌道重疊越多,電子在兩核間的概率密度越大���,形成的共價鍵就越穩(wěn)定���。除s軌道呈球形對稱外����,p��、d����、f軌道在空間都有一定的伸展方向。在成鍵時為了達到原子軌道的重疊��,形成的共價鍵必然會有一定的方向性���。
例如氫與氯結合形成HCl分子時�����,氫原子的1s電子與氯原子的一個未成對電子(設處于3px軌道上)配對成鍵時有三種重疊方式����。只有H原子的1s原子軌道沿著x軸的方向向Cl原子的3px軌道接近�����,才能達到最大的重疊��,形成穩(wěn)定的共價鍵(圖2(1))���。
圖2所示的s原子軌道接近px軌道的方式中���,原子軌道同號重疊與異號重疊部分相等,正好相互抵消�,這種重疊為無效重疊。故氫與氯在這個方向上不能結合�。
圖2(3)所示的接近方向中,二原子軌道同號部分重疊較(1)為少���,結合較不穩(wěn)定��,氫原子有移向x軸的傾向��。共價鍵的方向性決定了共價分子具有一定的空間構型���。
總結:共價鍵有飽和性,成單電子的數(shù)目就是成鍵數(shù)目���; 共價鍵有方向性����,沿軌道方向重疊可產生最大重疊,形成的鍵���;在所有軌道中只有 s 軌道無方向性����,只有 s 軌道之間形成的鍵無方向性~����!
共價鍵的穩(wěn)定性首先與參與鍵的原子有關,原子間的電負性差越大形成的共價鍵一般越穩(wěn)定�;原子的原子半徑越小形成的共價鍵也越穩(wěn)定。還與原子參與組合的價軌道有關(對稱性)�, σ 對稱性穩(wěn)定性一般高于 π ,而 π 又高于 δ ��。


